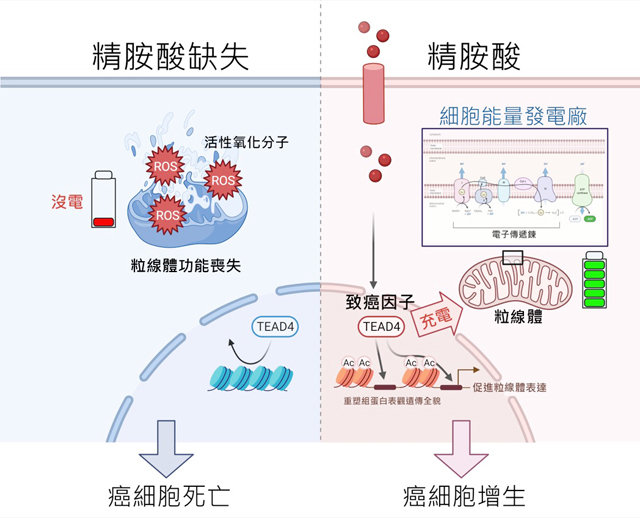
中央研究院龔行健院士帶領由臺北醫學大學及國家衛生研究院組成的研究團隊最新研究發現:在攝護腺癌中,癌細胞是藉由外來的精胺酸(arginine)來重塑表觀遺傳(epigenetics)全貌,以達調控粒線體蛋白質的表現,並維持粒線體提供能量給癌細胞的正常功能,只要不讓癌細胞吸收外來的精胺酸,進而讓癌細胞粒線體功能喪失,就可餓死癌細胞而達治療目的。
 研究團隊更進一步發現,在精胺酸調控粒線體蛋白質的表現及功能上,致癌基因 (oncogene)TEAD4扮演著不可或缺的角色。此一新穎而重要的研究由龔行健團隊成員、國衛院獨立博士後研究學者陳嘉霖主導且為第一作者,龔院士為通訊作者,本校講座教授閻雲、CRISPR核心實驗室朱珍瑩主任及北醫附設醫院癌症中心葉劭德主任等為共同作者,研究論文「精胺酸在攝護腺癌細胞中扮演表觀遺傳的角色,並藉由致癌基因TEAD4調控粒線體的功能」〈
研究團隊更進一步發現,在精胺酸調控粒線體蛋白質的表現及功能上,致癌基因 (oncogene)TEAD4扮演著不可或缺的角色。此一新穎而重要的研究由龔行健團隊成員、國衛院獨立博士後研究學者陳嘉霖主導且為第一作者,龔院士為通訊作者,本校講座教授閻雲、CRISPR核心實驗室朱珍瑩主任及北醫附設醫院癌症中心葉劭德主任等為共同作者,研究論文「精胺酸在攝護腺癌細胞中扮演表觀遺傳的角色,並藉由致癌基因TEAD4調控粒線體的功能」〈
Arginine is an epigenetic regulator targeting TEAD4 to modulate OXPHOS in prostate cancer cells〉於2021年4月23日刊登在全球知名醫學期刊《自然通訊》(Nature Communications)。【左圖:研究論文在《自然通訊》的PDF檔】
根據衛生福利部統計,國內攝護腺癌的發生率與死亡率逐年攀升。最近每年國內有超過5,000個新病例被診斷出來。攝護腺切除術或放射線治療對尚未轉移的攝護腺癌,雖具有一定程度的療效,但考量到攝護腺癌好發族群大都是65歲以上銀髮族,加上尿失禁、性功能障礙等術後併發症所造成的困擾與不便,消極性的荷爾蒙治療仍是目前被廣為接受的第一線治療方式。
然而,荷爾蒙治療並無法完全遏止攝護腺癌細胞的繼續成長,大部分患者的病情還是會隨時間拉長而惡化,造成癌細胞進一步增生、轉移及擴散;因此,如何不過度依賴荷爾蒙治療,另利用腫瘤細胞自身的特定代謝需求,進而開發新的治療策略已迫在眉睫。
陳嘉霖博士表示,過去普遍認為癌症是由基因突變這個單一因素所引起,目前則認為除此之外,改變表觀遺傳機制的表現,也是導致癌症的另一成因。因此針對特定胺基酸來重塑表觀基因的全貌,進一步調控制癌基因並阻斷粒線體提供癌細胞能量的外來管道,就可達到餓死癌細胞的目的。粒線體素有細胞的能量發電廠 (the power house of the cell)之稱,是細胞中主要進行能量代謝反應的工廠。
要餓死癌細胞,可先從尋找癌細胞的代謝缺陷著手,而精胺酸合成缺陷就是最常見的癌細胞代謝缺陷之一。根據先前研究,幾乎所有攝護腺癌細胞都缺乏精胺酸代謝的關鍵酵素—ASS1,無法自行合成精胺酸,導致癌細胞必須倚賴細胞外的精胺酸來維持生命,只要阻斷癌細胞取得外來精胺酸的管道,就可把癌細胞殺死。
龔院士研究團隊為癌症基因及癌症代謝研究的先驅。近來更針對癌細胞的精胺酸合成缺陷,利用精胺酸脫亞胺酶(ADI),可阻斷癌細胞吸收外來精胺酸的管道,迫使無法自行合成精胺酸的癌細胞粒線體功能喪失。
利用這種方法,可以更專一性的餓死癌細胞,比起目前廣泛使用的化療 (chemotherapy)毒死癌細胞或以放射性治療(irradiation)來燒死癌細胞,副作用更低。未來更可進一步使用精胺酸脫亞胺酶合併現行賀爾蒙療法做輔助治療,一舉解決去勢抗性和治療抗性的難題。
本研究成果對於基礎醫學及轉譯醫學研究都有重要影響,尤其對癌症代謝療法無疑帶來一線新的曙光。完全不含精胺酸成分的飲食療法,已成功在動物模式中抑制攝護腺癌細胞的生長,未來若能發展出「精胺酸飲食限制療法」,再合併搭配使用其他已知藥物,降低高毒性藥物的劑量,減少藥物副作用,同時提升癌症治療的效果,可望進一步協助攝護腺癌患者擺脫惡性腫瘤的威脅,重新找回健康。(文/秘書處)【下圖:攝護腺癌細胞必須依賴外來的精胺酸來維持「細胞的能量發電廠」粒線體的正常功能】