李學耘助理教授畢業於臺北醫學大學藥學系,取得臺灣大學藥學系博士學位後,返回北醫大藥學系劉景平教授實驗室擔任博士後研究員,並於2013年擔任專案助理教授,2015年成為藥學系專任教師。
李學耘助理教授畢業於臺北醫學大學藥學系,取得臺灣大學藥學系博士學位後,返回北醫大藥學系劉景平教授實驗室擔任博士後研究員,並於2013年擔任專案助理教授,2015年成為藥學系專任教師。
 研究內容著重在小分子抗癌化合物開發及活性天然物全合成路徑建立。研究所期間利用微波加速器改良橢圓玫瑰樹鹼(ellipticine)全合成速率及總產率,有助於後續相關衍生物開發與結構藥效關係(structure-activity relationship, SAR)的探討。
研究內容著重在小分子抗癌化合物開發及活性天然物全合成路徑建立。研究所期間利用微波加速器改良橢圓玫瑰樹鹼(ellipticine)全合成速率及總產率,有助於後續相關衍生物開發與結構藥效關係(structure-activity relationship, SAR)的探討。
博士後研究時期,研究主題著重在抗微管劑(antitubulin agent)及HDAC抑制劑的合成。這段期間有機會加入臺北醫學大學和臺大醫學院共同組成的抗癌新藥團隊,參與臨床試驗中抗癌分子「MPT0E028」開發,過程讓我深深感受到實驗桌上的粉末原來是許多病患的救命希望,加深自己對研究及人才培育的責任感,也覺得「新藥開發」在臺灣已是可實現的夢想。【左圖:李學耘助理教授攝於實驗室】
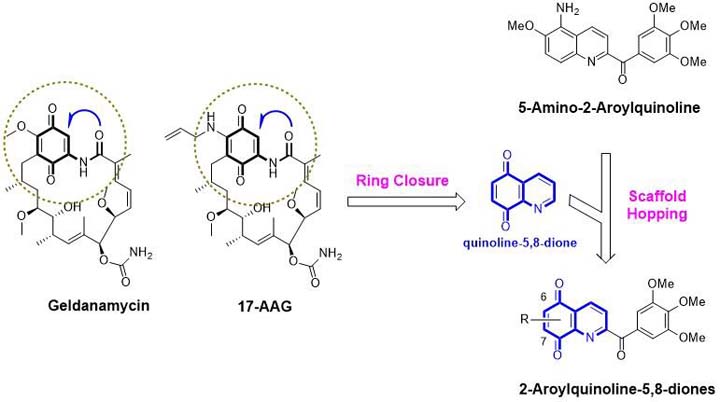
活性化合物結構的設計靈感常來自於大自然,天然化合物獨特的結構,提供藥物化學家化學模板,透過一些藥物設計的策略,便能將其設計成極具新穎性的活性化合物。本實驗室最近的研究即以天然物「geldanamycin」為起始點。它是種從「streptomyces hygroscopicus」分離而得的「benzoquinone ansamycin antibiotic」,具有熱休克蛋白(Heat shock protein 90, HSP90)的抑制能力,以及強效的抗癌細胞生長活性,並於1994年進入臨床試驗;然而,它所產生的肝毒性限制其後續發展,也導致較安全的衍生物「17-AAG」的開發。17-AAG即是將geldanamycin結構中的「methoxy基」取代為「allylamino基團」,也具有HSP90抑制活性,及抗癌細胞增生能力。
geldanamycin及17-AAG結構中的「quinone」和鄰接的「Amide官能基」,進行「閉環策略修飾」(ring closure),發現「quinoline-5,8-dione」是合適的核心結構(core structure),因此將過去合成的強效抗微管劑「5-amino-2-aroylquinoline」進行骨架跳躍(scaffold hopping),設計、合成一系列「2-aroylquinoline-5、8-diones」,生物測試結果顯示這系列化合物不僅維持原有的抗微管聚合能力,也能抑制HSP90表現,並能進一步發展為新穎的抗癌小分子。(文/李學耘,臺北醫學大學藥學系專任教師)【下圖:2-aroylquinoline-5、8-diones的設計策略】