 卵巢癌是一極為困難治療的婦科惡性腫瘤,其致死率與治療後的復發比率都相當高。我們致力於找尋有效的免疫治療策略來治療此一惡性腫瘤,以期將來能實際應用於臨床上。
卵巢癌是一極為困難治療的婦科惡性腫瘤,其致死率與治療後的復發比率都相當高。我們致力於找尋有效的免疫治療策略來治療此一惡性腫瘤,以期將來能實際應用於臨床上。
 研究指出趨化因子(chemokine)基質細胞生合成一號因子(SDF-1)/CXCL12及其受體CXCR4結合作用是決定卵巢癌啟始、進展與轉移的主要因素。並且相信阻斷趨化因子及其受體(CXCR4-CXCL12)的結合作用路徑,有機會用於治療臨床上的卵巢癌病人。另外,近期研究也顯示gamma delta(γ/δ)T淋巴細胞可以有效毒殺易產生化療抑制性的癌症幹細胞(cancer stem cell; CSCs),為一種有希望的卵巢癌免疫治療方法。【圖:劉兆蓮助理教授】
研究指出趨化因子(chemokine)基質細胞生合成一號因子(SDF-1)/CXCL12及其受體CXCR4結合作用是決定卵巢癌啟始、進展與轉移的主要因素。並且相信阻斷趨化因子及其受體(CXCR4-CXCL12)的結合作用路徑,有機會用於治療臨床上的卵巢癌病人。另外,近期研究也顯示gamma delta(γ/δ)T淋巴細胞可以有效毒殺易產生化療抑制性的癌症幹細胞(cancer stem cell; CSCs),為一種有希望的卵巢癌免疫治療方法。【圖:劉兆蓮助理教授】
因此,我們分幾個方向探討具有潛力的免疫治療策略及其治療機轉:
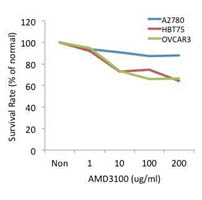 1.我們首先使用shRNA或趨化因子受體抑制劑(CXCR4 antagonist),例如:AMD3100來降低趨化因子受體(Cxcr4)在卵巢癌細胞株中的表現,以避免趨化因子與其受體(Cxcl12/Cxcr4)的結合,並釐清及追蹤各種不同方式阻斷治療後的效果。【右圖:細胞毒殺試驗中,拮抗劑AMD3100對卵巢癌細胞株的毒殺能力測試。針對俱有表現受體CXCR4的細胞株HBT75 與OVCAR3及其不表現CXCR4控制組細胞株A2780進行不同濃度(1、10、100、200ug/ml)受體拮抗劑AMD3100的毒殺測試,得知在HBT75與OVCAR3毒殺後的細胞存活率有明顯下降】
1.我們首先使用shRNA或趨化因子受體抑制劑(CXCR4 antagonist),例如:AMD3100來降低趨化因子受體(Cxcr4)在卵巢癌細胞株中的表現,以避免趨化因子與其受體(Cxcl12/Cxcr4)的結合,並釐清及追蹤各種不同方式阻斷治療後的效果。【右圖:細胞毒殺試驗中,拮抗劑AMD3100對卵巢癌細胞株的毒殺能力測試。針對俱有表現受體CXCR4的細胞株HBT75 與OVCAR3及其不表現CXCR4控制組細胞株A2780進行不同濃度(1、10、100、200ug/ml)受體拮抗劑AMD3100的毒殺測試,得知在HBT75與OVCAR3毒殺後的細胞存活率有明顯下降】
 2.接下來,我們利用aminobisphosphonates與低劑量白細胞介素-2(interleukin-2) 活化並增生俱有毒殺作用的γ/δ T淋巴細胞(γδ-T cells)來測試治療卵巢癌細胞株或腫瘤幹細胞 (sphere cells)的效果。
2.接下來,我們利用aminobisphosphonates與低劑量白細胞介素-2(interleukin-2) 活化並增生俱有毒殺作用的γ/δ T淋巴細胞(γδ-T cells)來測試治療卵巢癌細胞株或腫瘤幹細胞 (sphere cells)的效果。
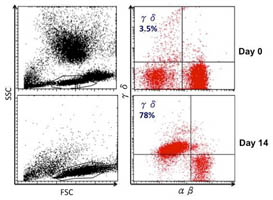
3.由於目前大部分有關卵巢癌研究,多是利用體外(in-vitro)細胞培養證實的結果,對於將來轉譯醫學應用前所需適用的卵巢癌動物模式及其詳細治療機制目前仍舊十分缺乏。因此,我們將建立一個高度類似人類漿液性(high-grade serous) 卵巢癌的小鼠模式,此漿液性卵巢癌(high-grade serous carcinoma, HGSC)是最常見的惡性卵巢癌。【左圖:人類毒殺性淋巴球(γδ-T cells)的增生。借由體外(in-vitro)培養方式,我們利用aminobisphosphonates與低劑量白細胞介素-2(interleukin-2)活化並增生俱有毒殺作用的γ/δ T淋巴細胞,經14天的培養將原本只有3.5%的γδ-T淋巴細胞增生達78%】
利用這一HGSC小鼠,我們將檢視趨化因子及其受體(Cxcl12/Cxcr4)作用路徑如何參與卵巢癌的調控與治療。也將結合活化其內生性γ/δ T淋巴細胞毒殺作用來共同治療此HGSC卵巢癌小鼠,預期將會有突破性治療效果,並為將來臨床上治療卵巢癌病人提供可執行的新穎策略。(文/劉兆蓮,醫學科技學院醫學檢驗暨生物技術學系助理教授)

